Updated (2024.07.03)
폰탄환자와 폰탄수술이란?

단심실을 가진 환아들에게 최종적으로 시행하는 수술을 폰탄 수술(Fontan operation)이라고 합니다. 두 개의 혈액순환을담당해야 할 펌프가 하나밖에 없으므로, 이 하나의 펌프로는 전신으로 혈액을 공급하는 역할을 담당하게 합니다.이렇게 되면 폐순환을 담당할 펌프가 없으므로, 전신을 순환하고 온 혈액이 심장을 거치치 않고 바로 폐로 흘러갈 수 있도록새로운 길을 만들어 주는 수술이 폰탄 수술이라고 이해하면 됩니다.
PRV는 다음의 3가지 형태의 질환에 부여가 됩니다.
(1) 전염성 풍토병 등의 열대성 질환(2007년부터 부여)
(2) 소아 희귀질환(2012년부터 부여)
(3) 희귀 난치성 질환
제약회사가 미국FDA에 품목허가를 신청할 때 우선 심사권(PRV)를 사용하면, 통상 10개월이 걸리는 일반심사(Standard Review)가 아닌 6개 월정도가 소요되는 우선심사(Priority Review)를 받게 되어 허가에 필요한 기간을 4개 월정도를 단축할 수 있습니다. 그리고 PRV는 제3자에게 양도가 가능합니다.
---------------------------------------------------------------------------------------------------------------------------
1. 2002년 동아제약에서 동아팜텍으로 분사하여 2013년 현 상호로 변경하였으며 신약후보 물질의 도입, 개발, 기술이전 사업을 영위 중인 C&D업체
2. 동아에스티 발기부전치료제 자이데나의 성분 유데나필의 북미와 러시아, 멕시코 특허 보유로 마일스톤과 사료사업 부문 매출이 주 수익원
3. 미 FDA 에서 폰탄환자 치료제로 개발과 임상을 권함으로 시작됨.
4. 최종 임상 3상 FUEL -1 진행 당시 경쟁 개발사 존슨앤존슨이 폐동맥고혈압 치료제 '옵서미트'(성분명 macitentan)를 폰탄 환자 치료제로 개발하던 연구를 중단 (2021.11.23)으로 경쟁사가 사라진 상황
5. 경쟁개발사가 있을 당시 노무라 증권 개발 성공시 시장 점유율 50% 적정시총 3조4천억 제시

6. 2022년 3월 임상 실험 유효성 입증 부족으로 글로벌 임상 3상 실패 (주가 7만원에서 만원까지 급락)
7. FDA에 신양허가 신청 NDA를 했으나 FDA에서 철회요청 (기존 자료를 살리도록 FDA에서 가이드를함)
8. 실패사유 약효가 듣지 않는 수술을 하고도 정상인과 같은 심장 운동능력을 가진 슈퍼폰탄환자가 존재함
9. 임상데이터 정리미흡으로(거꾸로 기재)+슈퍼폰탄 환자를 제외하고는 P 값이 0.02 98%의 약의 효능을 보임을 확인
10. FDA에서 찾어와 2차 유효성 입증을 위한 추가 임상을 요구 P 값을 0.1 90% 이상의 효능을 보인다면 허가를 약속

11. BRV를 통해서 500억 투자유치(당시 주가 18000원 백풋옵션없이 오직 주주로 투자함)
https://n.news.naver.com/article/018/0005475739?sid=101
[단독]메지온, BRV 500억 투자유치에 숨겨진 내막
이 기사는 2023년04월25일 09시10분에 팜이데일리 프리미엄 콘텐츠로 선공개 되었습니다. “시간을 우리 편으로 만들기 위한 전략입니다”. 메지온 홈페이지. 노성일 메지온 상무가 500억원 투자유
n.news.naver.com
https://marketinsight.hankyung.com/article/202306111358r
윤관 BRV CIO가 임상 실패했던 메지온에 500억 '베팅'한 이유[자본시장을 움직이는 사람들]
윤관 BRV CIO가 임상 실패했던 메지온에 500억 '베팅'한 이유[자본시장을 움직이는 사람들], 한국 모빌리티와 반도체 장비, 배터리, 제약바이오, 플랫폼 기업까지 공격적 투자 "신약 투자 경험 풍부
marketinsight.hankyung.com
12. FDA에 P 0.1 허가 맞는지 내용증명으로 확인받음
13. 실패한 임상에는 환자가 모이지 않는게 일반적이나.. 이미 부작용이 없고 효능이 검증된 약이라고 폰탄환우사이에서는 소문이 나서 그런지 빠르게 환자 모집됨
https://n.news.naver.com/mnews/article/018/0005657301
[단독]메지온 "유데나필 2차임상 대상자 3235명 확보...1차 대비 2배 이상"
이 기사는 2024년01월18일 08시55분에 팜이데일리 프리미엄 콘텐츠로 선공개 되었습니다. 메지온(140410)은 대규모 임상환자 확보로 ‘유데나필’ 2차 임상 3상의 성공 확률을 크게 높였다는 분석이
n.news.naver.com
14. 임상 3상 2차 추가임상 FUEL-2는 기존의 임상방식보다 단순화되어있고 실수없기 위해서 세계 1위 CRO업체인 아이큐비아에 위탁해서 진행
https://www.edaily.co.kr/news/read?newsId=02122166632528344
메지온, 유데나필 추가임상 CRO ‘아이큐비아’로 선정
메지온(140410)이 유데나필 추가 임상시험 임상시험수탁기관(CRO)으로 ‘아이큐비아’(IQVIA)를 선정했다고 22일 밝혔다.(제공=메지온)아이큐비아는 세게 100여 개국에 6만 8000명이 근무하고 있는 세
www.edaily.co.kr
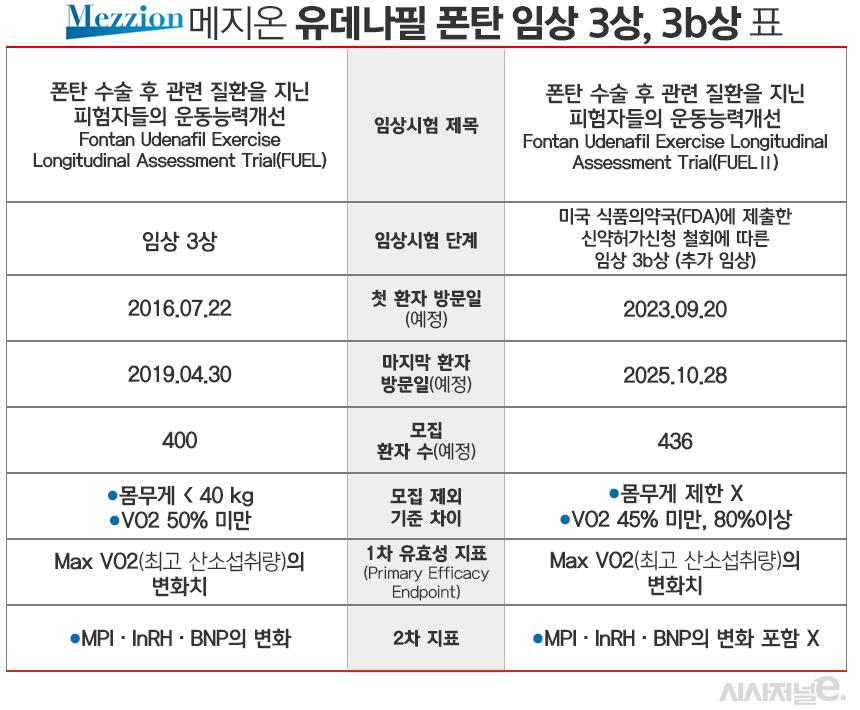
15. 2023년 10월을 기점으로 2차 임상이 시작됨 2025년 10월 마지막 환자 방문예정
https://www.sisajournal-e.com/news/articleView.html?idxno=301434
메지온, 폰탄 치료제 유데나필 3상 추가 임상···이번에는 FDA 문턱 넘을까
[시사저널e=김지원 기자]메지온이 폰탄 치료제로 개발 중인 유데나필의 3b상 임상 진행을 추진한다. 미국 식품의약국(FDA)의 제안에 따라 앞서 진행했던 3상에서 일부분을 바꾸어 임상시험에 들어
www.sisajournal-e.com
https://www.edaily.co.kr/news/read?newsId=01400566635513800&mediaCodeNo=257&OutLnkChk=Y
"실패할래야 실패할 수 없는 임상"...메지온, 유데나필 3상 재수 '성공' 자신
“유데나필은 p값 0.1 이내에만 들어오면 미국 식품의약국(FDA) 품목허가를 받습니다”. 유데나필 2차 임상 3상 전망을 묻자, 노성일 메지온(140410) 경영지원총괄 상무는 강한 자신감을 피력했다.노
www.edaily.co.kr
16. 임상중간값 발표 미충족시 환자수를 확대해서 표준편차를 줄여나갈생각 중간값 만족시 임상을 중단하고 바로 FDA에 NDA신청.
17. 보통 하루에 두알 평생을 먹어야하는 약임...먹지 않을시 심장기능약화로 30~40대 심장합병증 간섬유화등으로 인해 대부분이 사망하기때문 미국 보험사에서 약가가 연1만달러(1억원정도)내에서 보험적용이 가능할것이다라고 피드백을 받음
18. 미국에서만 확인 등록된 폰탄 환우만 3만명~7만명으로 추정 슈퍼폰탄환자도 예외없이 약을 복용권장함
19. 전세계 폰탄환우까지 생각하면 시장규모는 추정불가
20. 회사 PR자료 중 (2024.1.15)
https://classic.clinicaltrials.gov/ct2/history/NCT05918211?A=2&B=5&C=Side-by-Side#StudyPageTop
[12월18일 protocol 변경된내용]
Change from baseline to Week 26 in the Enhanced Liver Fibrosis (ELF) Score calculated by the change in the following biomarkers: hyaluronic acid, amino-terminal propeptide of type III collagen, and tissue inhibitor of metalloproteinase-1. subjects with scores of <7.7 were assigned to the no or mild fibrosis group; 7.7 to 9.8 to the moderate fibrosis group, and >9.8 to the severe fibrosis group.
[10월30일 protocol 내용]
Change from baseline to Week 26 in the ELF Score calculated by the change in the following biomarkers: hyaluronic acid, amino-terminal propeptide of type III collagen, and tissue inhibitor of metalloproteinase-1.
* Protocol(임상시험계획) 변경내용은 간섬유증 수치에 따른 환자구별이 위두개의 내용만 다름.
-> 7.7 이하 : 간섬유증이 없거나 경미한 그룹
-> 7.7 ~ 9.8 : 중간정도 간섬유증 구룹
-> 9.8 이상 : 중증 간섬유증 구룹
* 미국 임상은 순조롭게 진행중, 12개병원등록중 11개 대형병원에서 환자모집중이고 유데나필 약을 복용중에있음.
* 24년2월19~20일사이 식약처에 답변서와 최종protocol 한글본 제출완료.
* 식약처로부터 최종 승인을 득하면 즉시 거래소 공시예정
-> 한국 3개 병원에 대해서도 SIV(Site Initiation Visit)해서 교육 일정잡고 임상시작함.
-> 한국임상도 3월에 시작할것으로 보입니다.
23. (03.05/24) 기준
* 총 436 환자모집중 291명 남았읍니다.
* 총 436 환자모집중 145명이 약을 투약 받았읍니다.
Udenafil for Single Ventricle Heart Disease
Apply to this Phase 3 clinical trial treating Single Ventricle Heart Disease. Get access to cutting edge treatment via Udenafil, Placebo. View duration, location, compensation, and staffing details.
www.withpower.com
반드시 스마트폰사용해서 아래 링크에가셔서 제일밑에 하단에 291 spot left 로 표시됩니다.
24. 한국 식약처 임상시험 계획 변경 승인 신청 관련 (사측공지)
■ 오늘 한국 식약처로부터 당사가 제출했던 자료에 대한 사전검토 결과를 통보받았습니다.
식약처는, (1)1차 질의에 대한 당사의 보완과 (2)미국 FDA에 수정/제출되어 승인받은 프로토콜을 반영한 변경자료에 대해 중요한 요청사항은 없었고,
‘한국의 경우, 배송 서비스를 사용하지 않고 제11주, 제22주에 임상시험대상자가 대면 방문하여 직접 약물이 교부된다’ 라는 부분을 명확히 하는 설명부분을 추가하여 금주 내에 승인신청 자료 제출할 것입니다.
한국 식약처 내부의 승인절차를 거쳐서, 이후 승인 여부를 당사에 통보해 주는 기한은 4월 12일입니다.
■ 한국 식약처로부터의 승인통보를 받는 즉시, 거래소 공시를 통해 알려 드리겠습니다. 거래소 공시는 규정 상, “식약처로부터의 통보를 받는 즉시”입니다. 따라서 당사는 식약처로부터의 통보를 증명하는 자료를 첨부하여 거래소에 공시 승인을 요청하여야 합니다. 거래소의 승인이 나면 즉시 공시가 되므로, 당사는 공시 일자와 시간을 임의로 조정할 수 없는 것임을 미리 안내 드립니다.
■ 한국 식약처의 승인 예정일자에 가장 근접할 수 있도록 FUEL-2에 참여하는 한국의 3개 병원에 대한 SIV(Site Initiation Visit)가 실시될 수 있도록 미국의 책임자들의 방한 일정을 조율 중입니다.
참고로 FUEL-2에 참여하는 한국의 3개 병원은 이미 IRB 승인절차는 완료하였습니다.
25. 한국 3개병원 SIV완료
■ FUEL-2를 실시할 한국의 3개 병원(서울대병원/세브란스병원/세종병원)에 대한 SIV(Site Initiation Visit)가 7월 1일 (월)과 7월 2일 (화) 이틀에 걸쳐 모두 완료
■ 2024년 7월 1일자, clinicaltrials.gov에 업데이트 된 임상병원 현황을 안내 드립니다. 미국 현지 임상병원 중 ‘Recruiting’ 상태로, 환자 모집이 진행되고 있는 임상병원은 주요 대형병원 7곳을 포함한 21곳이며, ‘Not yet recruiting’ 로 표기된 임상병원은 이번 한국병원 3곳을 포함하여 6곳
기대적가치

유데나필 상업화 시 폰탄수술에 대한 유일무이한 First in Class 신약으로 높은 시장 침투율, 높은 영익률 (사측 주장 70% 수준이나, 보수적 50%로 계산) 및 현재 환율 약 1,300원 고려하여 계산해봄. 경쟁약물이 없는 유일무이 신약이지만 비싼 약가를 고려 시 침투율은 30~50%정도 고려해볼 수 있으나 보수적으로 20%수준 산정. 대부분을 보수적 수치로 계산하였으므로, 여기서 어떤 변수 하나라도 올라갈 경우 타겟시총은 각 변수의 곱에 의해 크게 변동될 수 있음. (각 변수 : 환자수, 약가, 환율, 침투율, 멀티플)
- 잠재시장 규모 : 미국환자 수 29,000명 추정 * 약가 6만 불 * 1,300원 = 2.26조원(약가 인플레이션 및 일반적 희귀약품 약가 중간값도 고려하지 않음)
- 회사 매출액(침투율 20% 보수적 가정) : 2.26조원 * 20% = 4,524억원
- 영업이익 : 보수적 50% 고려 시 2,262억원
- 멀티플 : 셀트리온 보통 Per 30 ~ 50 사이 정도인데 바이오 시밀러회사임. 본 약은 희귀 신약 및 유일한 약으로 인한 높은 침투율에도 단일 파이프라인, 타겟 시장이 작은 관계로 멀티플 20정도 준다 치면 목표시총은 약 4.5조원(현재 1조원 시총대비 약 4.5배 가능). 더 보수적으로 10배 멀티플 줘도 2.2조라 현재대비 100% 이상 가능
- 아직 밸류에이션은 미국만 타겟이고 유럽, 일본 등 국가 추가 시 시장 자체가 커지므로 업사이드는 더 높아질 수 있음.
폰탄수술 치료제 환자수도 예상보다 많은 점도 긍정적이다. 메지온은 기존에 미국의 폰탄수술 환자수를 약 3만명으로 추정했다. 그러나 최근 개최된 2018 바이오 인베스터 포럼에서 진단코드를 조회해본 결과, 예상되는 폰탄수술 환자수가 7만7966명으로 2배 이상이었다.
'투자종목' 카테고리의 다른 글
| 삼화전기(eSSD/S-CAP/Hybrid-CAP) (0) | 2024.08.09 |
|---|---|
| 테이팩스/2차전지용 테이프 독과점 (0) | 2024.06.30 |
| 더블유씨피/분리막 업체로서의 경쟁력 (0) | 2024.06.21 |
| 브이티/리들샷확장의 원년 (0) | 2024.03.25 |
| 퍼스트무버 아일리아 시밀러 삼천당제약 (2) | 2024.02.03 |



