2024년 미국 특허 만료 예정 상위 10개 의약품
국가신약개발사업단 기획팀 김효인 연구원
- * 출저: 자료발간일
2024-04-15
- 출처
국가신약개발재단
- 원문링크
◈본문
Overview
2023년 초, 글로벌 빅파마들은 블록버스터 의약품들의 특허 만료로 인한 매출 감소를 방어하고자 신규 파이프라인을 확보하기 위해 적극적으로 움직일 것으로 예측되었다. 그러나 2022년 초부터 기준금리를 인상해 오던 미국 연방준비제도가 2023년에 들어서도 지속적으로 기준금리를 인상하였으며, 바이든 정부도 2023년 8월 인플레이션 감축법(Inflation reduction act, IRA)에 따른 약가인하 협상 대상을 발표하는 등 여러 외부 요인이 발생함에 따라 상반기에 실제로 발표된 M&A나 파트너십 거래 실적은 저조한 편이었다.
그러나 2023년 9월부터 기준금리는 동결되기 시작해 현재까지 그 기조가 유지되고 있으며, 약가인하 협상 대상으로 확정 리스트업 된 블록버스터 의약품들은 대부분 독점권 만료가 임박한 제품으로 특허 만료와 함께 대비가 가능한 것으로 판단되면서 분위기는 바뀌기 시작했다. 글로벌 빅파마들은 급격한 금리 인상에 대비하기 위해 비축해 온 기업 잉여 현금 흐름(Free cash flow to firm, FCFF)을 바탕으로 신규 파이프라인 확보를 위해 2023년 하반기부터 본격적으로 움직이기 시작했으며, 약가 인하 회피 수단으로 기존 블록버스터 제품의 피하주사(SC) 제형 개발 또한 추진하기 시작해 특허 에버그리닝(Evergreening)은 더욱 강화될 것으로 보인다.
최근 미 복지부는 공중보건서비스법 351 조항을 개정하여 인터체인저블 바이오시밀러(Interchangeable biosimilar) 지정제도 삭제를 발표한 바 있다. 이에 따라 바이오시밀러 시장 경쟁이 더욱 치열해질 것으로 보이면서, 오리지널 의약품의 특허 만료는 향후 글로벌 빅파마들의 파이프라인 재정비 움직임과 제약·바이오 시장의 흐름에도 더 큰 영향을 미칠 것으로 보인다. 이에 본편에서는 FiercePharma가 소개한 2024년 미국 특허 만료가 예정된 상위 10개의 의약품(표 1) 중 상위 5건에 대해 본격적으로 알아보고자 한다.
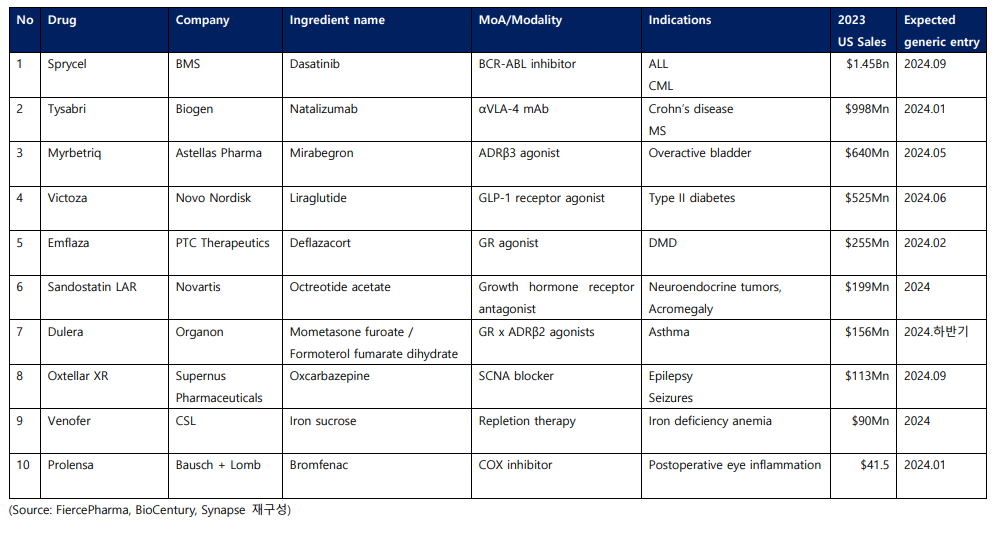
Sprycel(Dasatinib) 스프라이셀
2024년 특허 만료 예정 의약품 중 가장 가치가 높은 것으로 꼽힌 것은 BMS의 스프라이셀로, BCR-ABL 티로신 키나제 활성을 억제하여 세포 사멸을 유도하고 증식을 억제하는 기전의 만성골수성백혈병(Chronic myeloid leukemia, CML) 치료제다. 2006년, FDA의 가속승인을 획득한 스프라이셀은 글리벡(Glivec, Novartis, Imatinib mesylate, BCR-ABL inhibitor / ALL, CML, Hematologic malignancies)이나 타시그나(Tasigna, Novartis, Nilotinib, BCR-ABL inhibitor / CML) 등 다른 치료제에 반응하지 않거나 내약성이 없던 환자들의 2차 치료제로 사용되다 2010년부터 1차 치료제로 처방되기 시작했다.
BMS는 스프라이셀의 환형 단백질 티로신 키나제 억제제 특허 방어를 위해 2015년부터 본격적으로 쟁송해 왔으나, 해당 특허는 올해 3월 23일자로 만료되었다. 이에 특허 만료 전부터 진행해 온 아포텍스(Apotex) 및 기타 여러 회사와의 합의에 따라 올해 9월부터 제네릭들이 출시될 것으로 예상된다.
한편, 엑스프레이(Xspray Pharma)는 2023년 하반기 중 스프라이셀의 개량신약인 다사이녹(Dasynoc)을 출시할 계획이었으나 용량에 대한 추가 정보 제공 및 위탁제조시설에 대한 검토를 사유로 FDA로부터 CRL을 수령하며 승인 거부되었다. BMS와 특허 소송에 합의 후, 올해 2월 FDA에 다사이녹의 재승인을 신청한 엑스프레이는 9월 1일 이전에 미국 내 출시를 계획하고 있다.
Tysabri(Natalizumab) 타이사브리
타이사브리는 α4β1 과 VCAM-1, α4β7 과 MAdCAM-1 의 상호작용을 억제하는 기전의 항체 치료제다. 엘란(Elan Pharmaceuticals)과 바이오젠(Biogen)의 공동개발을 통해 개발된 타이사브리는 2013 년을 기점으로 바이오젠이 엘란으로부터 전체 권리를 인수하면서 바이오젠에 완전 귀속되어 전사 매출의 20% 이상을 차지하는 핵심 파이프라인이 되었다.
타이사브리는 2004 년에 다발성 경화증으로 FDA 의 승인을 받았지만, 간기능 부전과 같은 일반적인 부작용 외에도 진행성 다초점백질뇌병증(Progressive multifocal leukoencephalopathy, PML)이라는 희귀 신경질환 부작용으로 사망 2 건이 발생함에 따라 승인 3개월만에 회수 조치가 시행되기도 하였다. 그러나 안전성과 관련된 치명적인 부작용에도 불구하고 효능이 좋아, 다른 치료제에 반응하지 않는 환자의 2 차 치료에만 TOUCH®라는 필수 처방 프로그램과 함께 제한 처방된다는 전제 하에 2006 년에 재출시되어 시판되고 있으며 이후 2008 년 FDA 의 승인을 받아 크론병까지 적응증을 확장한 바 있다.
또한, 타이사브리의 경우 이미 지난해 8 월, FDA 의 승인을 받은 바이오시밀러로 산도즈(Sandoz)의 타이루코(Tyruko)가 존재한다. 타이루코는 타이사브리가 승인을 받은 모든 적응증에 대해 동일하게 승인 받았으며, 올해 1 월 독일에서 출시한 것을 시작으로 상반기 내 미국과 유럽에서 출시 예정이다.
Myrbetriq(Mirabegron) 미르베트릭
아스텔라스의 미르베트릭은 선택적 β3 아드레날린 수용체에 작용하여 방광 근육을 이완시키는 과민성 방광 치료제다. 미르베트릭은 2012 년 FDA 의 승인을 받았으며, 2021 년에는 3 세 이상 소아의 신경인성 배뇨근 과활동(Neurogenic detrusor overactivity, NDO) 치료제로 적응증을 추가로 확대하였다. 미르베트릭의 규제 독점기간은 올해 9 월 25 일을 기준으로 종료될 예정이며, 용도특허 및 결정특허는 그 이전인 올해 5 월 중으로 만료될 예정이다. 한편, 지난해 6 월 델라웨어주 연방지방법원이 2030 년까지 예정되어 있던 서방제제에 대해 특허 무효 판결을 내렸고 이에 불복한 아스텔라스 측은 연방순회항소법원(the U.S. court of appeals for the federal circuit, CAFC)에 항소할 계획이라 밝혔다. 그러나 이후 계쟁 상황에 대해 업데이트 된 내역은 없으며, 루핀(Lupine Labs/2022.09)과 자이더스(Zydus Cadila/2022.09), 그리고 알켐(Alkem Labs/2024.02)은 제네릭 버전에 대해 FDA 승인을 획득한 상태다.
Victoza(Liraglutide) 빅토자
노보노디스크의 빅토자는 혈당 상승 시 췌장 베타 세포가 인슐린을 분비할 수 있도록 유도하는 GLP-1 수용체 작용제다. 빅토자는 2010년에 제 2형 당뇨병 치료제로 FDA 의 승인을 받았으며, 2014 년에는 빅토자와 동일한 리라글루타이드 성분의 저용량(3mg) 버전이 저칼로리 식이요법과 신체활동을 병행한 만성 체중 관리 치료제로 승인받아 삭센다(Saxenda)라는 이름으로 출시되기도 했다.
그간 1 세대 GLP-1 당뇨병 치료제로 독점적 지위를 누려왔던 빅토자는 후속 약물인 오젬픽;위고비(Ozempic; Wegovy, Novo Nordisk, Semaglutide, GLP-1 receptor agonist/Type II diabetes; Obesity)와 마운자로;젭바운드(Mounjaro; Zepbound, Eli Lilly, Tirzepatide, GLP-1 receptor agonist/Type II diabetes; Obesity) 등의 출시 이후 점진적으로 매출이 감소하는 추세이며, 특허는 올해 5월 23일을 기준으로 만료될 예정이다. 한편, 테바(Teva Pharmaceutical)와 비아트리스(Viatris), 산도즈(Sandoz)는 노보노디스크와 이미 특허 합의를 완료하여 2024 년 중 제 2 형 당뇨병에 대한 제네릭 출시를 준비하고 있는 것으로 알려져 있다.
Emflaza(Deflazacort) 엠플라자
엠플라자는 면역계 활성을 낮추어 염증 및 통증을 감소시키는 코르티코스테로이드제로 뒤센형 근이영양증(Duchenne muscular dystrophy, DMD)의 치료제다. 마라톤 파마(Marathon Pharma)가 개발한 엠플라자는 미국에서 DMD 치료를 위해 정식 승인을 받은 최초의 스테로이드제로, 2017 년 2 월에 FDA 의 승인 및 희귀의약품 지정을 받은 직후 PTC 가 모든 권리를 매입하여 환자들에게 제공해왔다.
엠플라자 인수 당시 PTC 는 자사에서 개발 중인 트랜슬라나(Translarna, PTC Therapeutics, Ataluren, Dystroglycan stimulants/DMD)의 본격 출시 전, DMD 치료제 시장의 기반을 구축하기 위해 엠플라자를 인수한다고 밝힌 바 있다. 트랜슬라나는 2014 년에 FDA 와 EMA 의 조건부 승인을 받아 시판 중이었으나 아직까지 FDA 의 정식 승인을 받지 못했을 뿐만 아니라 올해 1 월에는 EMA 로부터 승인 갱신을 거절당해 유럽 시장에서는 철수의 위기에 놓여 있기도 하다. PTC 는 올해 내로 다시 한 번 FDA 에 트랜슬라나의 정식 승인을 신청할 예정이다.
엠플라자의 특허는 대부분 이미 만료되었으며, 인도의 아우로빈도(Aurobindo)가 지난 2 월 FDA 로부터 데플라자코트(Deflazacort)의 제네릭 정제에 대한 FDA 의 최종 승인을 받아 시판 중이다.
'뉴스 기록및정리' 카테고리의 다른 글
| LG화학, 2026년부터 日 PPES에 양극재 공급 (0) | 2024.10.10 |
|---|---|
| 2024년 7월 22일 바이든 대선후보 사퇴 (0) | 2024.07.22 |
| 한국 원팀코리아 30조원 체코원전 사업 수주 쾌거 (0) | 2024.07.17 |
| 미국 생물보안법 (0) | 2024.07.16 |
| 이재명 당대표 출마 연설중(금투세 관련 요약) (5) | 2024.07.11 |



